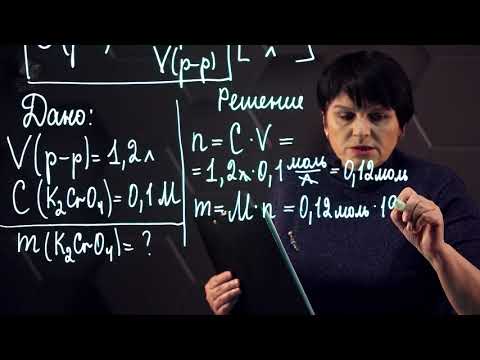
Содержание
- Шаг 1: определить количество молей NaOH в образце
- Шаг 2: Посмотрите молярную массу NaOH
- Шаг 3: Определите количество эквивалентов
нормальность единица концентрации в кислотно-щелочной химии, которая обычно выражается в эквивалентах на литр. Эквивалентом является количество эквивалентных весов (не масса) вещества. Эквивалентный вес, в свою очередь, представляет собой молярную массу вещества, деленную на число ионов водорода (H +) или гидроксида (OH-), с которыми одна молекула вещества реагирует в растворе.
Например, карбонат кальция, который имеет формулу CaCO3, имеет молярную массу 100,1 г. Вы можете определить это из любой периодической таблицы элементов. Ca имеет молярную массу 40,1, C молярную массу 12 и O молярную массу 16, что делает общую молярную массу карбоната кальция равной 40,1 + 12 + 3 (16) = 100,1. Потому что ион кальция имеет положительный заряд 2 и существует как Са2+каждая молекула CaCO3 потенциально может реагировать с двумя ионами ОН-. Таким образом, эквивалентный вес СаСО3 составляет 100,1 ÷ 2 = 50,05 г / экв.
В результате этого получается 1 л раствора, содержащего, например, 200,2 г CaCO.3 (т.е. 2 моль) будет иметь молярность 2 М, но будет иметь нормальность 2 Н, поскольку эквивалентная масса СаСО3 только половина его молекулярной массы, что означает, что 1 моль = 2 уравнения
Этот принцип применим и к другим соединениям, например, к гидроксиду натрия (NaOH). Для расчета нормальности раствора NaOH:
Шаг 1: определить количество молей NaOH в образце
Предположим для этой проблемы, что у вас есть 0,5 л 2,5 М раствора NaOH. Это означает, что у вас есть 1,25 моль всего NaOH.
Шаг 2: Посмотрите молярную массу NaOH
Из таблицы Менделеева молярная масса Na = 23,0, масса) = 16,0, а масса H = 1,0. 23 + 16 + 1 = 40 г.
Шаг 3: Определите количество эквивалентов
У вас есть 1,25 моль вещества с молярной массой 40,0 г.
(1,25 моль) (40 г / моль) = 50 г
Поскольку валентность NaOH составляет 1, для этого соединения 1 моль = 1 экв. Это означает, что для растворов NaOH нормальность и молярность одинаковы, в отличие от случая с CaCO.3.
При этом нормальность вашего раствора NaOH = 2,5 н.