Содержание
- TL; DR (слишком долго; не читал)
- Что такое гемоглобин?
- Обзор структуры белка
- Структура полипептида
- Третичная и четвертичная структура белка
- Опишите структуру молекулы гемоглобина
- Функции молекулы гемоглобина
- Как измененная структура гемоглобина влияет на функцию
- Гемоглобин и будущее лечение
Млекопитающие вдыхают кислород из воздуха через легкие. Кислород должен быть перенесен из легких в организм для различных биологических процессов. Это происходит через кровь, в частности, белок гемоглобин, содержащийся в эритроцитах. Гемоглобин выполняет эту функцию благодаря четырем уровням структуры белка: первичной структуре гемоглобина, вторичной структуре, а также третичной и четвертичной структурам.
TL; DR (слишком долго; не читал)
Гемоглобин - это белок в красных кровяных клетках, который придает ему красный цвет. Гемоглобин также выполняет основную задачу безопасной доставки кислорода по всему организму, и он делает это, используя свои четыре уровня структуры белка.
Что такое гемоглобин?
Гемоглобин большая молекула белка содержится в эритроцитах. Фактически, гемоглобин - это вещество, придающее крови красный оттенок. Молекулярный биолог Макс Перуц открыл гемоглобин в 1959 году. Перуц использовал рентгеновскую кристаллографию для определения особой структуры гемоглобина. Он также в конечном итоге обнаружит кристаллическую структуру его дезоксигенированной формы, а также структуры других важных белков.
Гемоглобин является молекулой-носителем кислорода для триллионов клеток организма, необходимых для жизни людей и других млекопитающих. Он транспортирует как кислород, так и углекислый газ.
Эта функция происходит из-за уникальной формы гемоглобина, который является глобулярным и состоит из четырех субъединиц белков, окружающих группу железа. Гемоглобин претерпевает изменения в своей форме, чтобы помочь сделать его более эффективным в функции переноса кислорода. Чтобы описать структуру молекулы гемоглобина, нужно понять, как устроены белки.
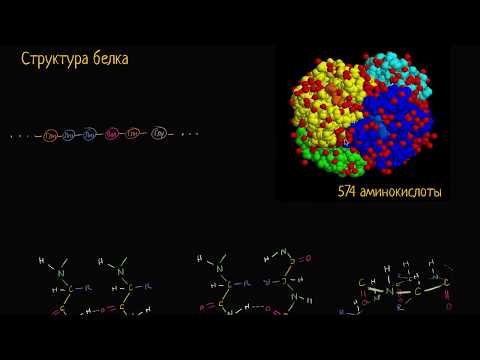
Обзор структуры белка
Белок представляет собой большую молекулу, состоящую из цепочки более мелких молекул, называемых аминокислоты, Все белки обладают определенной структурой благодаря своему составу. Существует двадцать аминокислот, и когда они связываются вместе, они образуют уникальные белки в зависимости от их последовательности в цепи.
Аминокислоты состоят из аминогруппы, углерода, группы карбоновой кислоты и присоединенной боковой цепи или R-группы, что делает ее уникальной. Эта R-группа помогает определить, будет ли аминокислота гидрофобной, гидрофильной, положительно заряженной, отрицательно заряженной или цистеина с дисульфидными связями.
Структура полипептида
Когда аминокислоты соединяются, они образуют пептидную связь и образуют полипептидная структура, Это происходит посредством реакции конденсации, в результате чего образуется молекула воды. Как только аминокислоты образуют полипептидную структуру в определенном порядке, эта последовательность составляет первичная структура белка.
Тем не менее, полипептиды не остаются в прямой линии, а скорее изгибаются и складываются, образуя трехмерную форму, которая может выглядеть как спираль ( альфа спираль) или что-то вроде формы аккордеона бета-плиссированный лист). Эти полипептидные структуры составляют вторичная структура белка, Они удерживаются вместе через водородные связи.
Третичная и четвертичная структура белка
Третичная структура белка описывает конечную форму функционального белка, состоящего из его компонентов вторичной структуры. Третичная структура будет иметь специфические порядки для своих аминокислот, альфа-спиралей и бета-складчатых листов, которые все будут складываться в стабильную третичную структуру. Третичные структуры часто образуются по отношению к окружающей их среде, например, с гидрофобными частями внутри белка и гидрофильными частями снаружи (как в цитоплазме).
Хотя все белки обладают этими тремя структурами, некоторые состоят из нескольких аминокислотных цепей. Этот тип структуры белка называется четвертичная структура, делая белок из нескольких цепей с различными молекулярными взаимодействиями. Это дает белковый комплекс.
Опишите структуру молекулы гемоглобина
Как только можно описать структуру молекулы гемоглобина, легче понять, как связаны структура и функция гемоглобина. Гемоглобин структурно похож на миоглобин, используемый для хранения кислорода в мышцах. Однако четвертичная структура гемоглобина выделяет его.
Четвертичная структура молекулы гемоглобина включает четыре третичные структуры белковых цепей, две из которых являются альфа-спиралями, а две - бета-плиссированными листами.
По отдельности каждая альфа-спираль или бета-складчатый лист представляет собой вторичную полипептидную структуру, состоящую из аминокислотных цепей. Аминокислоты в свою очередь являются основной структурой гемоглобина.
Четыре цепи вторичной структуры содержат атом железа, который находится в так называемой хем группакольцевая молекулярная структура. Когда млекопитающие вдыхают кислород, он связывается с железом в группе гемов. В гемоглобине есть четыре гемовых участка, с которыми кислород может связываться. Молекула удерживается вместе своим корпусом эритроцита. Без этой защитной сетки гемоглобин легко развалится.
Связывание кислорода с гемом инициирует структурные изменения в белке, что также приводит к изменению соседних полипептидных субъединиц. Первый кислород является наиболее сложным для связывания, но тогда три дополнительных кислорода способны быстро связываться.
Структурная форма изменяется из-за связывания кислорода с атомом железа в гемовой группе. Это смещает аминокислоту гистидин, который, в свою очередь, изменяет альфа-спираль. Изменения продолжаются через другие субъединицы гемоглобина.
Кислород вдыхается и связывается с гемоглобином в крови через легкие. Гемоглобин несет этот кислород в крови, доставляя кислород туда, где он необходим. Когда в организме увеличивается содержание углекислого газа и снижается уровень кислорода, выделяется кислород и снова изменяется форма гемоглобина. В конце концов все четыре молекулы кислорода высвобождаются.
Функции молекулы гемоглобина
Гемоглобин не только переносит кислород через кровоток, он также связывается с другими молекулами. Оксид азота может связываться с цистеином в гемоглобине, а также с гемовыми группами. Этот оксид азота высвобождает стенки кровеносных сосудов и снижает кровяное давление.
К сожалению, окись углерода также может связываться с гемоглобином в губительно стабильной конфигурации, блокируя кислород и приводя к удушению клеток. Угарный газ делает это быстро, делая его очень опасным, так как это токсичный, невидимый и не имеющий запаха газ.
Гемоглобины встречаются не только у млекопитающих. В бобовых есть даже тип гемоглобина, называемый леггемоглобином. Ученые считают, что это помогает бактериям фиксировать азот в корнях бобовых. Он имеет сходство с гемоглобином человека, главным образом из-за его железосвязывающей аминокислоты гистидина.
Как измененная структура гемоглобина влияет на функцию
Как уже упоминалось выше, структура гемоглобина изменяется в присутствии кислорода. У здорового человека нормально иметь некоторые индивидуальные различия в первичной структуре гемоглобина аминокислотных конфигураций. Генетические вариации в популяциях проявляются, когда возникают проблемы со структурой гемоглобина.
В серповидноклеточная анемиямутация в аминокислотной последовательности приводит к скоплению дезоксигенированных гемоглобинов. Это изменяет форму красных кровяных клеток, пока они не станут похожими на серп или серповидную форму.
Это генетическое изменение может оказаться вредным. Серповидноклеточные эритроциты уязвимы для повреждения и потери гемоглобина. Это в свою очередь приводит к анемии или низкому содержанию железа. Люди с серповидноклеточными гемоглобинами обладают преимуществом в областях, склонных к малярии.
При талассемии альфа-спирали и бета-плиссированные листы не производятся одинаково, что негативно влияет на гемоглобин.
Гемоглобин и будущее лечение
Из-за проблем с хранением крови и соответствием группам крови исследователи ищут способ сделать искусственную кровь. Работа продолжается над созданием новые типы гемоглобинаНапример, один с двумя остатками глицина, которые удерживают его вместе в растворе, а не распадаются при отсутствии защитной эритроцита.
Знание четырех уровней структуры белка в гемоглобине помогает ученым придумать способы лучше понять его функцию. В свою очередь, это может привести к новому назначению фармацевтических препаратов и других медицинских препаратов в будущем.