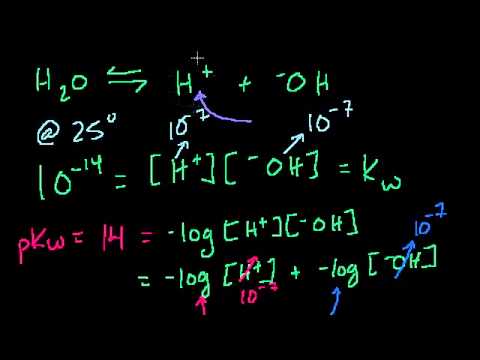
Содержание
Будучи студентом-химиком, вы узнаете, как рассчитать pH и pOH кислот и оснований. Концепции и расчеты не сложны, если вы знакомы с логарифмами и концентрацией решений.
TL; DR (слишком долго; не читал)
Для расчета pH = - log (H3O+ концентрация ионов). Расчет для pOH is - log (OH- концентрация ионов).
Значение pH и pOH
Для кислот и оснований концентрация раствора включает в себя числа, которые могут изменяться в широком диапазоне значений - от миллиона до одного. В отличие от большинства единиц, которые являются линейными, pH и pOH основаны на общем (основание 10) логарифме, что позволяет выражать значения в одну или две цифры, которые в противном случае охватывали бы многие порядки величины. Хотя это требует привыкания, компактность единиц pH и pOH удобна и экономит время и путаницу. Единица pH указывает на кислотность, где меньшие числа означают более высокие концентрации H3O+ (гидрония) ионы, и варьируются от более 14 (очень щелочные) до отрицательных чисел (очень кислотные; эти отрицательные числа используются в основном в научных целях). По этой шкале рН деионизированной воды равен 7. Шкала рОН очень похожа на рН, но обращена. Он использует ту же систему нумерации, что и pH, но измеряет OH- ионов. В этом масштабе вода имеет то же значение (7), но вы найдете основания на нижнем уровне и кислоты на верхнем уровне.
Расчет рН
Чтобы рассчитать pH по молярной концентрации кислоты, возьмите общий логарифм H3O+ концентрация ионов, а затем умножить на -1: pH = - log (H3O+). Например, каков pH 0,1 М раствора соляной кислоты (HCl), если предположить, что кислота полностью диссоциирована на ионы в растворе? Концентрация H3O+ количество ионов составляет 0,1 моль на литр. pH = - log (.1) = - (- 1) = 1.
Расчет pOH
Расчет для pOH следует тем же правилам, что и для pH, но использует концентрацию OH- ионы: рОН = - log (OH-). Например, найти pOH 0,02 М раствора гидроксида натрия (KOH). Концентрация ОН- количество ионов составляет 0,02 моль на литр. рОН = - log (.02) = - (- 1,7) = 1,7.
Добавление pH и pOH
Когда вы вычисляете как pH, так и pOH для данного раствора, цифры всегда складываются до 14. Например, pH и pOH воды равны 7, а 7 + 7 = 14. 0,02 М раствор гидроксида натрия в примере. выше будет иметь рН 12,3. Это означает, что если вы знаете pH, вы можете вычесть его из 14, чтобы найти pOH, и наоборот.