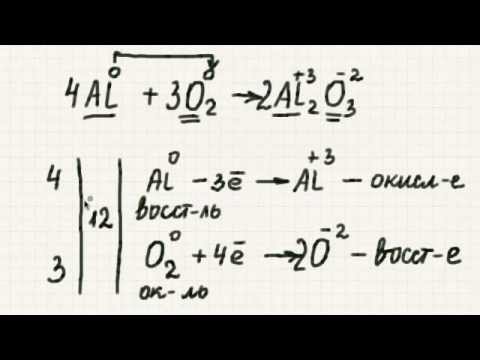
Содержание
Когда два элемента реагируют, они образуют соединение, делясь, даря или принимая электроны. Когда связываются два существенно разных элемента, таких как металл и неметалл, один элемент контролирует другие электроны большую часть времени. Хотя говорить о том, что не происходит обмена, не совсем точно, такое разделение настолько сильно в пользу одного элемента, что для всех практических целей говорят, что его партнер пожертвовал или «потерял» свой электрон.
Электроотрицательность
Электроотрицательность описывает тенденцию элемента приобретать электроны. Этот атрибут был официально определен Линусом Полингом в 1932 году, который также разработал количественное измерение электроотрицательности, которое сегодня называется шкалой Полинга. Элементы, которые с наибольшей вероятностью могут потерять электроны в реакции, это те элементы, которые являются самыми низкими по шкале Полинга или являются наиболее электроположительными. Поскольку электроотрицательность обычно увеличивается при переходе от нижнего левого угла таблицы Менделеева к верхнему правому углу, элементы в нижней части группы 1А падают наименьшее по шкале, при этом цезий и франций набирают 0,7. Практически в любой реакции щелочные металлы в группе 1А и щелочноземельные металлы в группе 2А теряют свои электроны по отношению к своим более электроотрицательным партнерам.
Ионные облигации
Когда два элемента а со значительной разницей в электроотрицательности реагируют, образуется ионная связь. В отличие от ковалентной связи, в которой оба атома разделяют внешние электроны, более электроположительный элемент в ионной связи теряет большую часть своего контроля над электроном. Когда это происходит, оба элемента называются «ионами». Элемент, который потерял свой электрон, называется «катион» и всегда указывается первым в химическом названии. Например, катион в хлориде натрия (поваренная соль) представляет собой щелочной металл натрия. Элемент, который принимает электрон от катиона, называется «анион» и получает суффикс «-ide», как в хлориде.
Окислительно-восстановительные реакции
Элемент в своем естественном состоянии имеет равное количество протонов и электронов, что дает ему нулевой заряд; однако, когда элемент теряет электрон как часть химической реакции, он становится положительно заряженным или окисляется. В то же время элемент, который взял электрон, становится более отрицательно заряженным или восстановленным. Эти реакции называются окислительно-восстановительными или окислительно-восстановительными реакциями. Поскольку донор электронов или окисленный элемент вызывает восстановление другого элемента, он называется восстановителем.
Льюис Бэйзс
Основание Льюиса - это любой элемент, ион или соединение, которое теряет несвязанную пару электронов с другим элементом, ионом или соединением. Поскольку более электроположительный элемент всегда теряет свои электроны, это всегда тот вид, который становится основой Льюиса. Отметим, однако, что не все основания Льюиса полностью теряют свои электроны; например, когда две неметаллические связи, электроны часто делятся, хотя и неравномерно. Однако когда металл связывается с неметаллом, в результате получается основание Льюиса с ионной связью, в котором металл для всех практических целей потерял свою электронную пару.